Example 13.7
Reaksi 2A → B orde kedua dengan konstanta langka 51/M. min pada 24 °C. (a) Dimulai dengan [A]0 = 0,0092 M, berapa lama [A]t = 3,7 × 10-3 M? (b) Hitung waktu paruh reaksi.
Jawab:
a) Reaksi orde 2: 2A → B
Konstanta laju reaksi orde dua, k = 51/M .min
Konsentrasi A pada waktu t = 0, [A]0 = 0,0092 M
Konsentrasi A pada waktu t = t, [A]t = 3,7 × 10-3 M
Menurut hukum tarif terintegrasi dari kinetika orde-2,
Subtitusikan nilai [A]t, [A]0, dan k pada persamaan orde-2 untuk menghitung waktu yang dibutuhkan untuk menurunkan konsentrasi reaktan A dari 0,0092 M menjadi 3,7 × 10-3 .

Waktu yang dibutuhkan untuk menurunkan konsentrasi reaktan A dari 0,0092 M ke 3,7 × 10-3 adalah 3,2 min.
Example 14.6
Pertimbangkan kesetimbangan berikut pada 395 K:
Tekanan parsial masing-masing gas adalah 0,265 atm. Hitung KP dan Kc reaksi.
Jawab:
Konstanta kesetimbangan (K) adalah hubungan antara produk dan reaktan dalam reaksi kesetimbangan. Untuk reaksi homogen diberikan sebagai berikut:
Dimana Kp adalah kesetimbangan konstan dalam hal tekanan parsial dan Kc adalah kesetimbangan konstan dalam hal konsentrasi.
Hubungan antara Kp dan Kc diberikan sebagai berikut:
Kp = Kc (0,0821T)Δn
Dimana T adalah temperatur dan Δn adalah perbedaan jumlah mol gas antara produk dan reaktan.
Persamaan reaksi kesetimbangan adalah sebagai berikut:
Diketahui bahwa tekanan parsial gas adalah 0,265 atm dan suhu T = 395 K. Kp untuk reaksi dihitung sebagai berikut:
Kp dari reaksi adalah 0,0702.
Hubungan antara Kp dan Kc diberikan sebagai berikut:
Kp = Kc (0,0821T)Δn
Subtitusikan nilai Kp = 0,0702, T = 395 K dan Δn = 2.
Nilai Kc dari reaksi adalah 6,68 × 10-5.
Example 15.4
pH suatu jus jeruk adalah 3,33. Hitung konsentrasi ion H +.
Jawab:
Logaritma negatif konsentrasi ion hidrogen H+ disebut sebagai pH larutan.
pH = - log [H+]
pH jus jeruk = 3,33
Konsentrasi ion hidrogen H + yang ada dalam jus jeruk adalah 4,7 × 10-4 M
Example 16.5
Tepat 100 mL asam nitrat 0,10 M (HNO2) dititrasi dengan larutan NaOH 0,10 M. Hitung pH untuk (a) larutan awal, (b) titik di mana 80 mL basa telah ditambahkan, (c) titik ekivalen, (d) titik di mana 105 mL basa telah ditambahkan.
Jawab:
a) Mulailah dengan menuliskan reaksi kimia untuk larutan yang sedang dikerjakan. Kemudian akan diketahui spesies mana yang ada dalam larutan.
HNO2 (aq) ⇌ H+ (aq) + NO2- (aq)
Kosentrasi larutan = 0,10 M
Volume larutan HNO2, V = 100 mL

Hitung mol dalam larutan HNO2
Untuk menghitung pH larutan awal, perlu mengetahui konsentrasi ion H+ dalam larutan.
HNO2 (aq) ⇌ H+ (aq) + NO2- (aq)
Selesaikan konsentrasi H+ menggunakan Ka.
Hitung pH larutan
Jadi, pH larutan awal adalah 2,67.
(b) pH setelah 80 mL basa ditambahkan.
Mulailah dengan menghitung jumlah mol yang ditambahkan ke larutan.
Kosentrasi larutan NaOH = 0,080 L x 0,10 mol/L = 0,0080 mol
Kosentrasi H+
pH larutan
pH larutan awal adalah 3,95.
(c) Titik ekivalen.
Titik ekivalen adalah titik di mana jumlah mol asam sama dengan jumlah mol basa.
Langkah selanjutnya adalah menghitung konsentrasi garam.
Selanjutnya hitung pOH dari larutan menggunakan Kb larutan.


Jika pOH adalah 5,48, maka pH larutan adalah 8,52 karena jumlah pH dan pOH suatu larutan harus sama dengan 14.
(d) Hitung pH setelah 105 mL basa ditambahkan.
Mulailah dengan menghitung jumlah mol yang ditambahkan ke larutan.
Langkah selanjutnya adalah menghitung mol setiap spesies setelah dilakukan penjumlahan.
Cari pOH dari larutan tersebut.
Jadi, pH larutan adalah 11,39, karena jumlah pH dan pOH sama dengan 14.
Example 17.1
Bagaimana entropi sistem berubah untuk setiap proses berikut? (a) uap air kondensasi, (b) pembentukan kristal sukrosa dari larutan jenuh, (c) pemanasan gas hidrogen dari 60 ° C hingga 80 ° C, dan (d) sublimasi es kering.
Jawab:
Entropi adalah ukuran ketidakteraturan suatu sistem. Itu berarti jika molekul atau partikel suatu sistem acak, entropi lebih banyak. Jika molekul teratur, entropi rendah.
Sekarang kita dapat memverifikasi entropi sistem berikut.
(a) Ketika Anda memadatkan air dari gas menjadi cairan, molekul-molekulnya menjadi lebih teratur. Artinya entropi tersebut menurun.
Oleh karena itu, entropi menurun dalam kasus ini.
(b) Saat senyawa berpindah dari fase larutan ke fase padat, molekul menjadi lebih teratur. Molekul gula dalam fase larutan lebih acak dan entropi lebih banyak. Tetapi dalam keadaan kristal, molekul menjadi dekat dan entropi berkurang.
Oleh karena itu, entropi menurun dalam kristalisasi gula.
(c) Saat gas hydrogen dipanaskan dari 60⁰ ke 80⁰, molekul-molekulnya bergerak lebih cepat sehingga keteraturannya berkurang. Ini berarti entropinya meningkat.
Oleh karena itu, entropi meningkat pada gas pemanas.
(d) entropi meningkat. Sublimasi adalah proses pengubahan suatu zat dari keadaan padat menjadi gas secara langsung. Ketika Anda menyublimkan es kering, molekul menjadi kurang teratur. Ini berarti entropinya meningkat.
Oleh karena itu, entropi meningkat.
Example 18.3
Berapa emisi standar sel galvanik yang terbuat dari
elektroda Cd dalam larutan Cd(NO3)2 1,0 M dan elektroda Cr dalam larutan Cr(NO3)3
1,0 M pada 25 ° C?
Jawab:
Mulailah dengan memeriksa potensial reduksi standar dari dua
setengah reaksi.

Berdasarkan aturan diagonal, Cd2+ akan
mengoksidasi Cr. Tuliskan reaksi keseluruhan yang seimbang.

Sekarang dapat diselesaikan ggl dengan mengambil perbedaan
dalam potensial reduksi katoda dan anoda. Koefisien dalam reaksi seimbang tidak
mempengaruhi perhitungan.

Example 17.1
Bagaimana entropi sistem berubah
untuk setiap proses berikut? (a) uap air kondensasi, (b) pembentukan kristal
sukrosa dari larutan jenuh, (c) pemanasan gas hidrogen dari 60 ° C hingga 80 °
C, dan (d) sublimasi es kering.
Jawab:
Entropi adalah ukuran
ketidakteraturan suatu sistem. Itu berarti jika molekul atau partikel suatu
sistem acak, entropi lebih banyak. Jika molekul teratur, entropi rendah.
Sekarang kita dapat memverifikasi
entropi sistem berikut.
(a) Ketika air dipadatkan dari gas menjadi cairan, molekul-molekulnya menjadi lebih teratur. Artinya entropi
tersebut menurun.
Oleh karena itu, entropi menurun
dalam kasus ini.
(b) Saat senyawa berpindah dari
fase larutan ke fase padat, molekul menjadi lebih teratur. Molekul gula dalam
fase larutan lebih acak dan entropi lebih banyak. Tetapi dalam keadaan kristal,
molekul menjadi dekat dan entropi berkurang.
Oleh karena itu, entropi menurun
dalam kristalisasi gula.
(c) Saat gas hidrogen dipanaskan
dari 60⁰
ke 80⁰,
molekul-molekulnya bergerak lebih cepat sehingga keteraturannya berkurang. Ini
berarti entropinya meningkat.
Oleh karena itu, entropi meningkat
pada gas pemanas.
(d) entropi meningkat. Sublimasi adalah proses pengubahan suatu zat dari keadaan padat menjadi gas secara langsung. Ketika es kering menyublim, molekul menjadi kurang teratur. Ini berarti entropinya meningkat.
Oleh karena itu, entropi meningkat.








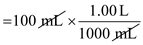
















Tidak ada komentar:
Posting Komentar