Chapter 1
1. Manakah di antara proses berikut yang tergolong perubahan fisika?
A. reduksi
B. oksidasi
C. solvasi
D. pirolisis
E. tidak ada pilihan yang tepat
Jawab : C
Solvasi, atau proses pelarutan suatu zat di dalam pelarutnya, tidak mengubah identitas kimia zat terlarut sehingga tergolong perubahan fisika
2. Perhatikan diagram berikut
Zat berikut ini yang menggambarkan diagram di atas berturut-turut adalah … .
A. gas hidrogen, gas helium, gas karbon dioksida
B. gas helium, gas karbon monoksida, gas nitrogen
C. gas helium, gas nitrogen, gas karbon monoksida
D. gas hidrogen, gas helium, gas nitrogen
E. gas helium, gas hidrogen, gas oksigen
Jawab: E
Gambar 1 menunjukkan gas monoatomik yaitu helium,
Gambar 2 menunjukkan gas diatomik dengan ikatan tunggal, yaitu hidrogen,
Gambar 3 menunjukkan gas diatomik dengan ikatan rangkap dua yaitu oksigen.
Chapter 2
3. John Dalton mengemukakan teori-teori berikut, kecuali ….
A. Semua materi tersusun dari atom-atom
B. Molekul terbentuk ketika 2 atau lebih atom yang berbeda bergabung menjadi satu
C. Atom akan mengalami pengaturan-ulang dalam suatu reaksi kimia
D. Atom terdiri dari bagian bermuatan positif dan negatif
E. Semua atom dari unsur yang sama adalah serupa dan berbeda dengan atom dari unsur lain
Jawab: D
John Dalton mengemukakan bahwa
– Atom tidak dapat dipecah lagi sehingga menurutnya tidak ada bagian positif/negatif atau apapun yang menyusunnya.
– Semua materi tersusun dari atom-atom
– Atom akan mengalami pengaturan-ulang dalam suatu reaksi kimia
– Semua atom dari unsur yang sama adalah serupa dan berbeda dengan atom dari unsur lain.
4. Pernyataan yang benar mengenai X56 dan X57 adalah …. kecuali
A. Merupakan isotop
B. Merupakan unsur yang sama
C. Mempunyai jumlah elektron yang sama
D. Mempunyai jumlah neutron yang sama
E. Mempunyai sifat kimia yang sama
Jawab: D
X56 dan X57 merupakan isotop yaitu atom yang sama mempunyai jumlah proton yang sama tetapi berbeda nomor massa dan neutronnya. Karena mempunyai jumlah elektron yang sama sehingga mempunyai sifat kimia yang sama. (Sifat kimia berkaitan dengan sifat reaksi).
Chapter 3
5. Senyawa oksida logam MxOy dihasilkan dari reaksi antara padatan logam M sebanyak 0,5 mol dengan 0,625 mol gas oksigen. Jika reaksi tersebut menghasilkan 0,25 mol oksida logam, maka rumus senyawa oksida tersebut adalah….
A. MO2
B. MO3
C. M2O
D. M2O3
E. M2O5
Jawab: E
Reaksi pembentukan oksida logam MxOy adalah sebagai berikut:
M + O2 → MxOy
0,5 mol 0,625 mol 0,25 mol
Perbandingan mol ≈ perbandingan koefisien. Perbandingan mol spesi tersebut adalah 4 : 5 : 2. Sehingga perbandingan koefisien spesi tersebut juga 4 : 5 : 2.
4M + 5O2 → 2MxOy
Untuk menentukan nilai x dan y, dilihat dari jumlah atom – atom.
Jumlah atom kiri harus sama dengan jumlah atom kanan.
Atom M kiri = atom M kanan
4 = 2x
x = 2
Atom O kiri = atom O kanan
10 = 2y
Y = 5
Sehingga rumus oksida tersebut adalah M2O5.
6. Berikut merupakan persamaan reaksi pembentukan gas SO3:
SO2(g) + O2(g) → SO3(g)
Jika gas oksigen yang digunakan sebanyak 12 L, maka volume gas SO3 yang dihasilkan adalah....
A. 6 liter
B. 12 liter
C. 18 liter
D. 24 liter
E. 36 liter
Jawab: D
Persamaan reaksi setara untuk penguraian gas SO3 adalah sebagai berikut:
2SO2 (g) + O2 (g) → 2SO3 (g)
Menurut hukum Gay Lussac, perbandingan volume spesi dalam reaksi fase gas sebanding dengan koefisien spesi tersebut.
Jika volume gas O2 = 12 L, maka:
![]()
Chapter 4
7. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang . . . .
A. Meningkatkan [H+] bila dimasukkan kedalam H2O
B. Menurunkan [H+] bila dimaasukkan kedalam H2O
C. Meningkatkan [OH–] bila dimasukkan kedalam H2O
D. Menerima 1 H+ dari pasangan reaksinya
E. Memberi 1 H+ dari pasangan reaksinya
Jawab: E
Teori asam Brosnted-Lowry:
Asam: zat yang memberikan 1 H+ pada pasangan reaksinya.
Basa: zat yang menerima 1 H+ dari pasangan reaksinya.
8. Reaksi Redoks :
Yang berperan sebagai oksidator pada reaksi di berikut adalah . . .
![]()
E. MnO2
Jawab: E
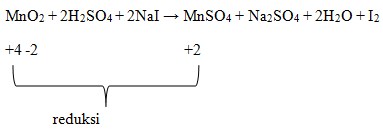
Diketahui bahwa oksidator yang mengalami reduksi atau penurunan biloks.
Dimana dilihat bahwa Mn pada MnO2 adalah +4.
Biloks Mn pad MnSO4 adalah +2.
Terjadi penurunan biloks, sehingga MnO2 menjadi oksidator.
Chapter 5
9. Sebanyak 4,0 gram cuplikan yang mengandung senyawa hidrokarbon dibakar sempurna dengan gas oksigen. Jika presentase (%) massa karbon dalam cuplikan tersebut adalah 30%, maka massa karbon dioksida yang dihasilkan dalam proses pembakaran tersebut adalah.... (Ar C = 12, O = 16)
A. 3,3
B. 4,4
C. 5,4
D. 5,5
E. 6,0
Jawab: B

dengan menganggap massa sebelum = massa sesudah reaksi, maka massa C dalam cuplikan akan sama dengan massa C dalam CO2. Sehingga:

10. Suatu gas ideal mula-mula menempati ruang yang volumenya V pada suhu T dan tekanan P. Jika suhu gas menjadi 3/2 T dan tekanannya menjadi 2 P, maka volume gas menjadi ….
A. 3/4 V
B. 4/3 V
C. 3/2 V
D. 3 V
E. 4 V
Jawab: A
A. Eksoterm, energi berpindah dari sistem ke lingkungan
B. Eksoterm, energi berpindah dari lingkungan kesistem
C. Endoterm, energi berpindah dari sistem ke lingkungan
D. Endoterm, energi berpindah dari lingkungan ke sistem
E. Endoterm, energi tidak berpindah
Jawab: D
Pada percobaan tersebut dikatakan endoterm, karena pada saat KNO3 beraksi dengan air, temperature nya turun karena tabung reaksi terasa dingin. Setelah sampai pada titik terendah, lama-kelamaan temperature akan naik kembali sampai temperature awal.
Penurunan temperature pada saat KNO3 bereaksi dengan air, menunjukkan bahwa reaksi menyerap kalor . Pada reaksi endoterm reaksi yang menyerap kalornya berpindah dari lingkungan ke sistem, sehingga kalor dari sistem akan bertambah. Sehingga lingkungannyaa terasa dingin atau pada soal lingkungannya tabung reaksi.
12. Dalam calorimeter terdapat zat yang bereaksi secara eksotermik dan ternyata 0,5 kg air yang mengelilinginya sebagai pelarut mengalami kenaikan temperature sebesar 3° Kalor jenis air = 4,2 J/gram K. Kalor reaksi zat yang dilepaskan oleh reaksi itu adalah..
A. 577,6 kJ
B. 578,6 kJ
C. 579,6 kJ
D. 5796 kJ
E. 57,96 kJ
Jawab: C
ΔT = 3°C
= 3 + 273 K = 276 K
Q = m.c. ΔT
= 500 gram x 4,2 J/gram K x 276 K
= 579.600 J = 579, 6 kJ
Chapter 7
13. Konfigurasi elektron untuk atom Na adalah 2 8 1. Berapakah bilangan kuantum untuk elektron valensinya? (berurutan n, l, m, s)
A. 3, 0, 0, -1/2
B. 3, 1, 1, +1/2
C. 3, 1, 0, -1/2
D. 3, 0, 1, +1/2
E. 3, 0, 0, +1/2
Jawab: E
Elektron valensi Na akan berada pada orbital 3s1 maka bilangan kuantumnya adalah n= 3, l=0, m = 0, s = +1/2.
14. Berikut ini syarat-syarat fungsi gelombang yang dapat diterima adalah …
A. Bernilai-tunggal
B. Square-integrable
C. Tidak bersifat kontinu
D. A dan B benar
E. A, B dan C benar
Jawab: D
Syarat-syarat agar suatu fungsi gelombang dapat diterima adalah : kontinu, memiliki turunan pertama yang kontinu, bernilai-tunggal dan square-integrable
Chapter 8
15. Energi ionisasi pertama, kedua, dan ketiga untuk unsur Na (dalam kJ/mol) adalah ....
A. 496, 4.560, dan 6.900
B. 578, 1.820, dan 2.750
C. 736, 1.450, dan 7.730
D. 786, 1.580, dan 3.230
E. 1.012, 1.904, dan 2.190
Jawab: A
Na merupakan unsur yang terletak pada golongan 1A dengan konfigurasi elektron 1s2 2s2 2p6 3s1 (2-8-1). Stabil ketika ia melepaskan elektron pertama (membentuk Na+) konfigurasi elektron Na 2-8.
Bila suatu spesi stabil (biasa elektron valensinya 8 seperti pada Na+) maka diperlukan energi yang besar untuk melepaskan lagi elektron yang dimiliki. Ini ditandai dengan energi ionisasi yang melonjak sangat besar dari sebelumnya.
16. Letak unsur X dengan nomor atom 26 dan nomor massa 56 dalam sistem periodik unsur terletak pada golongan dan periode…
A. IIA dan 6
B. VIB dan 3
C. VIB dan 4
D. VIIIB dan 3
E. VIIIB dan 4
Jawab: E
Menentukan letak unsur
![]()
Ingat bahwa 4s 3d merupakan salah satu karakteristik konfigurasi elektron unsur golongan B. Dari konfigurasi di atas diperoleh :
n = 4 → periode 4
eval (s+d) = 2 + 6 = 8 → golongan VIIIB
Chapter 9
17. Suatu senyawa mempunyai sifat sebagai berikut:
1. Mudah larut dalam air,
2. Dapat menghantarkan listrik dalam fase larutan, dan
3. Titik didih dan titik leleh tinggi.
Jenis ikatan yang terdapat dalam senyawa tersebut adalah …
A. Kovalen non polar
B. Logam
C. Hidrogen
D. Kovalen polar
E. Ion
Jawab: E
Sifat dari suatu senyawa diuraikan dalam tabel berikut.
 Berdasarkan sifat-sifat tersebut, jawaban yang benar adalah (E) Ion.
Berdasarkan sifat-sifat tersebut, jawaban yang benar adalah (E) Ion.
18. Senyawa berikut yang mempunyai 2 buah ikatan kovalen rangkap dua adalah .... (nomor atom S = 16, O = 8, C = 6, N = 7 dan Al = 13).
A. SO2
B. SO3
C. CO2
D. NO2
E. NH3
Jawab: C

Chapter 11
19. Perhatikan diagram P-T berikut!
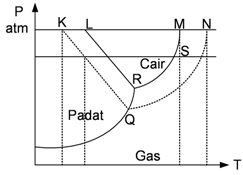 Garis beku pelarut ditunjukkan oleh….
Garis beku pelarut ditunjukkan oleh….
A. MS
B. MN
C. KL
D. LR
E. KQ
Jawab: D
K = titik beku larutan
L = titik beku pelarutKQ = garis beku larutan
LR = garis beku pelarut
20. Gaya intermolekul apasajakah yang ada pada partikel-partikel HI dan H2S?
L = titik beku pelarutKQ = garis beku larutan
LR = garis beku pelarut
- dipol-dipol dan ion-dipol
- gaya dispersi, dipol-dipol, dan ion-dipol
- gaya dispersi, ikatan hidrogen, dipol-dipol, dan ion-dipol
- gaya dispersi dan dipol-dipol
- gaya dispersi, dipol-dipol, dan ikatan hidrogen
Jawab: D
Gaya dispersi dimiliki oleh setiap zat yang berinteraksi. Demikian pula HI dengan H2S sudah pasti memiliki gaya dispersi. Ingat bahwa setiap spesi atau zat yang memiliki elektron akan memiliki gaya dispersi. Memang pengaruhnya biasanya kalah dibanding jenis interaksi lain bila ada bersamaan, namun tetap ada.
HI dan H2S merupakan molekul yang bersifat polar , pada molekul sesama polar maka terjadi interaksi dipol-dipol.
HI dan H2S tidak mungkin memiliki ikatan hidrogen, ikatan hidrogen hanya terjadi pada molekul yang punya ikatan H-F, H-O, H-N dan pada atom pusatnya harus memiliki PEB.
B. Terdapat gaya tarik-menarik antar molekul
C. Terdapat molekul yang tidak berpasangan
D. Terdapat banyak molekul yang sama
E. Terdapat molekul yabg besar ukuran partikelnya
Jawab: B
Jika kedalam pelarut dimasukkan zat terlarut yang sukar menguap maka tekanan uap pelarut tersebut akan turun disebabkan karena antara molekul zat terlarut dan molekul perlarut timbul gaya tarik-menarik.
22. Larutan elektrolit biner 5,85 gram dalam 500 gram membeku pada suhu -1,240C jika Kf air = 1,860C/m. Mr yang dibutuhkan adalah ….
A. 30,5
B. 29,5
C. 30,1
D. 35,1
E. 34,1
Jawab: D
Elektrolit biner → n = 2
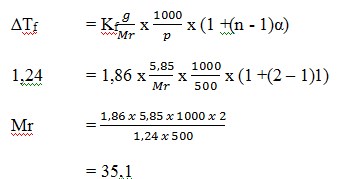


Tidak ada komentar:
Posting Komentar